


ГЛАВА I. СТРОЕНИЕ И СВОЙСТВА МЕТАЛЛОВ
§ 1. КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ
§ 1. КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ
Типы кристаллических решеток. Твердые тела делят на кристаллические и аморфные. Кристаллические тела при нагреве остаются твердыми до определенной температуры (температуры плавления), при которой они переходят в жидкое состояние. Аморфные тела при нагреве размягчаются в большом температурном интервале; сначала они становятся вязкими и лишь затем переходят в жидкое состояние.
Все металлы и их сплавы - тела кристаллические. Металлами называют химические элементы, характерными признаками которых являются непрозрачность, блеск, хорошая электро- и теплопроводность, пластичность, а для многих металлов также способность свариваться. Не потеряло своего научного значения определение металлов, данное более 200 лет назад великим русским ученым М. В. Ломоносовым: «Металлы суть светлые тела, которые ковать можно». Для металлов характерно то, что, вступая в химические реакции с элементами, являющимися неметаллами, они отдают последним свои внешние, валентные электроны. Это объясняется тем, что у атомов металла внешние электроны непрочно связаны с его ядром. Металлы имеют на наружных оболочках всего 1-2 электрона, тогда как у неметаллов таких электронов много (5-8).
Чистые химические элементы металлов (например, железо, медь, алюминий и др.) могут образовывать более сложные вещества, в состав которых могут входить несколько элементов-металлов, часто с примесью заметных количеств элементов-неметаллов. Такие вещества называют металлическими сплавами. Простые вещества, образующие сплав, называют компонентами сплава.
Для описания кристаллической структуры металлов пользуются понятием кристаллической решетки. Кристаллическая решетка - это воображаемая пространственная сетка, в узлах которой располагаются атомы (ионы), образующие металл. Частицы вещества (ионы, атомы), из которых построен кристалл, расположены в определенном геометрическом порядке, который периодически повторяется в пространстве. В отличие от кристаллов в аморфных телах (стекло, пластмассы) атомы располагаются в пространстве беспорядочно, хаотично.
Формирование кристаллической решетки в металле происходит следующим образом. При переходе металла из жидкого в твердое состояние расстояние между атомами сокращается, а силы взаимодействия между ними возрастают. Характер взаимодействия атомов определяется строением их внешних электронных оболочек. При сближении атомов электроны, находящиеся на внешних оболочках, теряют связь со своими атомами вследствие отрыва валентного электрона одного атома положительно заряженным ядром другого и т. д. Происходит образование свободных электронов, так как они не принадлежат отдельным атомам. Таким образом, в твердом состоянии металл представляет собой структуру, состоящую из положительно заряженных ионов, омываемых свободными электронами.
Связь в металле осуществляется электростатическими силами. Между ионами и свободными электронами возникают электростатические силы притяжения, которые стягивают ионы. Такую связь между частицами металла называют металлической.
Силы связи в металлах определяются силами отталкивания и силами притяжения между ионами и электронами. Ионы находятся на таком расстоянии один от другого, при котором потенциальная энергия взаимодействия минимальна. В металле ионы располагаются в определенном порядке, образуя кристаллическую решетку. Такое расположение ионов обеспечивается взаимодействием их с валентными электронами, которые связывают ионы в кристаллической решетке.
Типы кристаллических решеток у различных металлов различны. Наиболее часто встречаются решетки: объемно-центрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ). Наименьший объем кристалла, дающий представление об атомной структуре металла в любом его объеме, называют элементарной кристаллической ячейкой (рис. 1). Кристаллическая решетка характеризуется ее параметрами, например длиной ребра куба для ОЦК и ГЦК, которая составляет для разных металлов 2,8610-8 см.
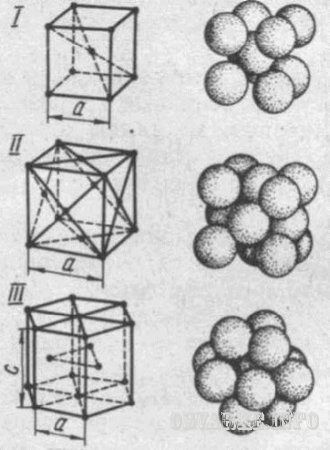
Рис.1. Элементарные ячейки кристаллических решёток:
I - кубическая объёмно-центрированная (-железо), II – кубическая гранецентрированная (медь); III – гексагональная плотноупакованная; а и с – параметры решёток
Дефекты в кристаллах. В кристаллах всегда имеются дефекты (несовершенства) строения, обусловленные нарушением правильного расположения атомов кристаллической решетки. Дефекты кристаллического строения подразделяют по геометрическим признакам на точечные, линейные и поверхностные.
Атомы совершают колебательные движения возле узлов решетки, и с повышением температуры амплитуда этих колебаний увеличивается. Большинство атомов данной кристаллической решетки имеют одинаковую (среднюю) энергию и колеблются при данной температуре с одинаковой амплитудой. Однако отдельные атомы обладают энергией, значительно большей средней энергии, и перемещаются из одного места в другое. Наиболее легко перемещаются атомы поверхностного слоя, выходя на поверхность. Место, где находился такой атом, называется вакансией (рис. 2, а). На это место через некоторое время перемещается один из атомов соседнего слоя и т. д. Таким образом вакансия перемещается в глубь кристалла. С повышением температуры количество вакансий увеличивается и они чаще перемещаются из одного узла в другой. В диффузионных процессах, протекающих в металлах, вакансии играют определяющую роль. К точечным дефектам относят также атом, внедренный в междоузлие кристаллической решетки (рис. 2, б), и замещенный атом, когда место атома одного металла замещается в кристаллической решетке другим, чужеродным атомом. Точечные дефекты вызывают местное искажение кристаллической решетки.
Линейные дефекты являются другим важнейшим видом несовершенства кристаллической решетки, когда в результате сдвига на одно межатомное расстояние одной части решетки относительно другой вдоль какой-либо плоскости число рядов атомов в верхней части решетки на один больше, чем в нижней. В данном случае в верхней части решетки появилась как бы лишняя атомная плоскость (экстраплоскость). Край экстраплоскости, перпендикулярный направлению сдвига, называется краевой, или линейной, дислокацией (рис. 2, в), длина которой может достигать многих тысяч межатомных расстояний. Шириной дислокации считают расстояние от центра дефекта до места решетки без искажения. Ширина дислокации мала и составляет несколько атомных расстояний.
Кристаллическая решетка в зоне дислокаций упруго искажена, поскольку атомы в этой зоне смещены относительно их равновесного состояния. Для дислокаций характерна их легкая подвижность. Это объясняется тем, что атомы, образующие дислокацию, стремятся переместиться в равновесное состояние. Дислокации образуются в процессе кристаллизации металлов (см. гл. 1, § 2), а также при пластической деформации, термической обработке и других процессах.
Поверхностные дефекты представляют собой границы раздела между отдельными кристаллами (рис. 2, г). На границе раздела атомы кристалла расположены менее правильно, чем в его объеме. Кроме того, по границам раздела скапливаются дислокации и вакансии, а также концентрируются примеси, что еще больше нарушает порядок расположения атомов. При этом сами кристаллы разориентированы, т. е. могут быть повернуты относительно друг друга на десятки градусов. Прочность металла может либо увеличиваться вследствие искажений кристаллической решетки вблизи границ, либо уменьшаться из-за наличия примесей и концентрации дефектов. Дефекты в кристаллах существенно влияют на свойства металлов.
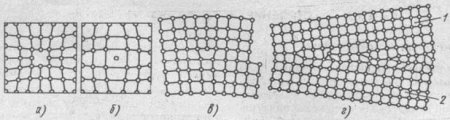
Рис. 2. Дефекты в кристаллах:
а - вакансия, б – внедрённый атом, в – краевая линейная дислокация, г – неправильное расположение атомов нна границе зерен 1 и 2
Анизотропия кристаллов. Неодинаковость физических свойств среды в разных направлениях называют анизотропией. Анизотропия кристаллов обусловлена различием плотности упаковки атомов в решетке в различных направлениях. Все кристаллы анизотропны, а аморфные тела (стекло, смола) изотропны, т. е. имеют одинаковую плотность атомов в различных направлениях.
Анизотропия свойств важна при использовании монокристаллов - одиночных кристаллов, частицы которых расположены единообразно по всему их объему. Монокристаллы имеют правильную кристаллическую огранку (в форме естественных многогранников), анизотропны по механическим, электрическим и другим физическим свойствам. Так, для монокристалла меди предел прочности σв изменяется от 120 до 360 МПа в зависимости от направления приложения нагрузки.
Металлы и сплавы, применяемые в технике, обычно имеют поликристаллическую структуру, т. е. состоят из множества мелких и различно ориентированных кристаллов, не имеющих правильной кристаллической огранки и называемых кристаллитами (или зернами). В каждом зерне поликристалла наблюдается анизотропия. Однако вследствие разнообразной, беспорядочной ориентировки кристаллографических плоскостей в различных зернах поликристалл может иметь одинаковые свойства по разным направлениям и не обнаруживать анизотропию (когда размеры зерен значительно меньше размеров поликристалла и количество их весьма велико). Это обстоятельство во многих случаях позволяет рассматривать поликристаллическое тело как подобное изотропному, несмотря на анизотропию свойств отдельных составляющих его зерен.



Уважаемый посетитель, Вы прочитали статью "Кристаллическое строение", которая опубликована в категории "Материаловедение". Если Вам понравилась или пригодилась эта статья, поделитесь ею, пожалуйста, со своими друзьями и знакомыми.
Наш сайт рекомендует:
22 марта 2010 | Просмотров: 47022 |



