


§ 62. Взаимодействие водорода, азота и сложных газов с расплавленным металлом сварочной ванны
Водород в составе газовой фазы может находиться в молекулярном или атомарном состоянии, что зависит от температуры. Металлы, способные растворять водород, можно разделить на две группы. К первой группе относятся металлы, не имеющие химических соединений с водородом (железо, никель, кобальт, медь и др.). Металлы первой группы поглощают водород в твердом состоянии, растворимость которого в них увеличивается при плавлении и зависит от состояния водорода.
Ко второй группе относятся металлы, образующие с водородом гидриды, представляющие химическое соединение металла с водородом (палладий, цирконий, титан, ванадий, торий, тантал и редкоземельные элементы). При небольших количествах поглощенного водорода эти металлы образуют с ним твердые растворы, а при более значительных количествах - гидриды.
Легирующие элементы оказывают самое разнообразное влияние на растворимость водорода в сплавах железа. Углерод, кремний, алюминий и хром снижают растворимость водорода в сплавах железа, а титан и ниобий ее увеличивают. Растворенный водород в сварочной ванне и его неполное выделение в период кристаллизации приводят к образованию дефектов: пор, макро- и микротрещин в металле шва, а также холодных и горячих трещин в околошовной зоне.
Концентрация водорода в сварочной ванне может быть уменьшена созданием нерастворимых соединений водорода в металле, например фтористого водорода HF, а также некоторым окислением сварочной ванны.
Азот. При нормальных условиях азот химически малоактивен, и при обычной температуре он вступает в реакцию только с литием, образуя нитрид лития: N2+6Li=2Li3N. С кремнием азот образует три химических соединения: SiN (32,59% N), Si2N3 (42,79% N) и Si3N4 (39,96% N), имеются сообщения о получении Si(N3)4.
Нитрид Si3N4 отличается высокой химической стойкостью и стойкостью против окисления до 1204°С, а в течение ограниченного времени и при температурах 1204-1399°С. В интервале температур 1600-1800°С Si3N4 разлагается по уравнению Si3N4=3Si+2N2.
Азот с марганцем образует следующие химические соединения: MnN (20,32% N), Mn3N2 (14,53% N), Mn2N (11,31% N), Mn5N2 (9,26% N) и Mn4N (5,99% N).
В зависимости от температуры в зоне дуги азот может находиться в молекулярном, атомарном и ионизированном состояниях. Источником азота в газовой фазе зоны дуги служит окружающая атмосфера.
Растворимость азота в железе обусловливается его состоянием в газовой фазе. Азот не растворяется в меди, никеле, золоте, серебре и не образует с этими металлами химических соединений. С железом он образует нитриды Fe2N (11,15% N) и Fe4N (5,9% N). Нитрид Fe2N в атмосфере чистого азота начинает разлагаться при Т≈550°С, а при повышении температуры происходит диссоциация Fe4N. Диссоциация нитридов, находящихся в металле, происходит тем интенсивнее, чем выше концентрация азота в металле.
Азот способствует образованию пор в металле шва. Увеличение его концентрации в низкоуглеродистых сталях влияет на прочностные и пластические свойства этих сталей и способствует старению металла. Его вводят в состав легированных сталей для образования аустенитной структуры, где он является аустенитизатором и рассматривается как ценная легирующая добавка. По влиянию на растворимость азота в железе элементы могут быть расположены примерно в следующий ряд: Ti, V, Сг, Та, Мn, Мо и W. Эти элементы увеличивают в определенных условиях и пределах растворимость азота, а Al, Си, Zn, S, As, Со, Ni, Si, Р, О, С, Mg уменьшают его растворимость.
Углекислый газ. В составе газовой фазы зоны дуги углекислый газ СО2 присутствует в значительных количествах. Это особенно заметно при сварке электродами, покрытие которых создано на основе мрамора и плавикого шпата. В процессе плавления такого покрытия происходит диссоциация карбоната кальция с образованием углекислого газа СаСО3=СаО+СО2.
Углекислый газ активно окисляет жидкий металл
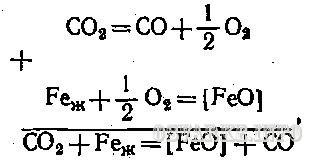
Образующаяся окись углерода СО в металле шва не растворяется, в процессе кристаллизации сварочной ванны она выделяется и образует поры. Углекислый газ может быть использован для защиты зоны сварки от воздуха, если в состав проволоки ввести марганец и кремний, которые будут нейтрализовать реакцию образования СО.
Водяной пар, находящийся в газовой фазе, образуется из влаги покрытия и влаги ржавчины, находящейся на поверхности свариваемых кромок, а также в результате реакций, протекающих в покрытиях и газовой фазе.
Водяной пар с жидким металлом взаимодействует по уравнению H20+Feж=[FeO]+Н2. При электрической сварке плавлением газовая фаза зоны дуги, контактирующая с жидким металлом, состоит из смеси С02, СО, Н2О, Н2, О2, N2, а также продуктов их диссоциации (О, Н, N, ОН) и паров металла и шлака.
Кислород, находясь в сварочной ванне, образует с железом оксид FeO, который, растворяясь в сварочной ванне, снижает прочностные свойства металла шва. Водород, оставшийся в расплавленном металле, впоследствии является причиной образования холодных трещин.



Уважаемый посетитель, Вы прочитали статью "Взаимодействие газов с расплавленным металлом", которая опубликована в категории "Ручная дуговая сварка". Если Вам понравилась или пригодилась эта статья, поделитесь ею, пожалуйста, со своими друзьями и знакомыми.
Наш сайт рекомендует:
1 февраля 2012 | Просмотров: 12885 |



