Из теории металлургических процессов известно, что чем больше химическое сродство данного металла с кислородом и чем меньше упругость диссоциации его окисла, тем большей устойчивостью обладает этот окисел и тем труднее восстановить данный металл.
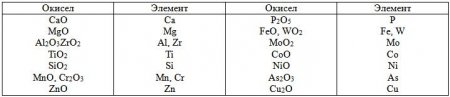
Применяемые для восстановления металла из окисла вещества (газ, жидкость или твердое тело) должны обладать большим химическим сродством к кислороду, нежели восстанавливаемый металл, а окислы этих восстанавливающих веществ должны обладать меньшей упругостью диссоциации, чем окисел восстанавливаемого металла (табл. 4). Из табл. 4 видно, что наибольшей упругостью диссоциации обладает окись меди Сu2О и наименьшей - окись кальция СаО.
Таблица 4
Окислы некоторых металлов не могут быть восстановлены газами средней зоны сварочного пламени (рис. 46). При сварке железа и никеля газы средней зоны нормального ацетилено-кислородного пламени в известной мере предупреждают образование окислов этих металлов, так как они сравнительно хорошо восстанавливаются окисью углерода (СО) и водородом (Н и Н2). Однако магний, алюминий, цинк и другие металлы не восстанавливаются газами пламени, и для их восстановления или связывания их окислов прибегают обычно к флюсам - веществам, вводимым в сварочную ванну для раскисления расплавленного металла и извлечения из него образующихся окислов и неметаллических включений. Кроме того, флюсы образуют на поверхности ванны пленку шлака и тем предохраняют металл от дальнейшего окисления и азотирования.
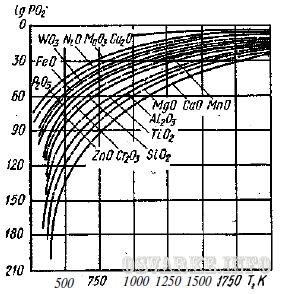
Рис. 46. Зависимость упругости диссоциации окислов от температуры
Необходимость применения флюсов при сварке высоколегированных сталей, чугуна, а также цветных металлов и сплавов возникает в связи с тем, что при нагревании последних до высокой температуры на их поверхности образуется пленка окисла, которая при расплавлении переходит в сварочную ванну и препятствует надежному сплавлению основного и присадочного металла. При сварке низкоуглеродистой стали эта пленка легко удаляется при перемешивании ванны и восстанавливается газами пламени.
К сварочным флюсам предъявляются следующие требования.
1. Флюс должен быть легкоплавким и иметь температуру плавления более низкую, чем температура плавления основного и присадочного металла.
2. Флюс должен обладать достаточно высокой реакционной способностью, с тем чтобы процесс растворения окислов металлов заканчивался до затвердения сварочной ванны.
3. Флюс не должен оказывать вредного влияния на металл.
4. Плотность флюса должна быть меньше плотности металла, с тем чтобы образуемый флюсом шлак легко всплывал на поверхность сварочной ванны.
5.. Свойства флюса не должны меняться под влиянием высокой температуры пламени.
6. Расплавленный флюс должен хорошо растекаться по нагретой поверхности металла.
7. Образуемый флюсом шлак должен хорошо защищать металл от окисления и азотирования кислородом и азотом воздуха и хорошо отделяться от шва при остывании металла.
Удалять окислы и неметаллические включения из жидкой ванны можно химическим путем и физическим растворением. В обоих случаях механизм действия флюса основан на законе распределения, согласно которому при соприкосновении двух несмешивающихся жидких фаз компонент, растворимый в обеих фазах, распределяется в них в постоянном при данной температуре отношении. В зависимости от того,какого характера окисел образуется в сварочной ванне, следует применять флюсы основные или кислые. При этом реакции протекают по следующей схеме: кислотный окисел + основной окисел = соль.
Если при сварке металлов образуются преимущественно основные окислы (исключение составляет титан), то флюс должен быть кислым, и, наоборот, если образующиеся в сварочной ванне окислы имеют кислый характер, то флюс должен быть основным. Кислые флюсы применяют преимущественно при сварке цветных металлов, в частности при сварке сплавов меди и сплавов алюминия, а основные, вернее сочетание основных с кислыми, - при сварке чугуна, содержащего высокий процент кремния и образующего в сварочной ванне, помимо окислов железа, кислотный окисел кремния (SiO2).
Флюсы для сварки меди и ее сплавов. Применяемые при сварке медных сплавов кислые флюсы обычно представляют собой соединения бора - буру Na2B4O7•10Н2О и борную кислоту Н3ВО3 или их смеси.
Перед употреблением буру необходимо прокаливать, так как в противном случае при нагревании она вспучивается, выделяет кристаллизационную воду и увеличивает количество водяных паров в зоне сварки.
Взаимодействие буры с окисью меди по одной из наиболее вероятных реакций может быть представлено следующим образом. При нагревании бура распадается на соль метаборной кислоты NaBO2 и борный ангидрид В2О3:
Na2B4O7→2NaBO2+В2О3,
которые, взаимодействуя с окисью меди, образуют двойную соль натрия и меди метаборной кислоты
2NaBO2+В2О3+CuO=(NaBO2)2•Си(ВО2)2.
Аналогично этому протекает реакция взаимодействия буры с окисью цинка
2NaBO2+В2О3+ZnO=(NaBO2)2•Zn(ВО2)2.
Помимо чисто химического действия буры, возможно также и непосредственное связывание борным ангидридом окислов меди и цинка, с образованием борнокислых солей Си•В2О3 и Zn•B2O3.
Применяя в качестве флюса борную кислоту, следует иметь в виду что она при нагревании до температуры 550-600°С полностью освобождается от воды и превращается в борный ангидрид, обладающий сильнокислыми свойствами:
2Н3ВО3→В2О3
Соединяясь с образующимся при сварке окислом меди или цинка, борный ангидрид, как и в случае применения в качестве флюса буры, образует борнокислые соли CuO•В2О3 или ZnO•В2О3.
Флюсы для сварки чугуна. При сварке чугуна, в сварочной ванне которого образуется тугоплавкий окисел кремния SiO2 (Тпл=1710°С), для растворения его в состав флюса вводят компоненты, обладающие основными свойствами. Такими компонентами обычно служат углекислый натрий Na2CO3 или углекислый калий К2СО3.
Взаимодействие углекислого натрия с окислом кремния протекает по реакции
2Na2CO3+SiO2=Na4Si04+2СО2.
Аналогично протекает и реакция взаимодействия углекислого калия с этим окислом:
2К2СО3+SiO2=K4Si04+2СО2.
В обоих случаях связанный окисел кремния в виде шлака всплывает на поверхность сварочной ванны.
Для растворения SiO2 возможно также применение двууглекислого натрия NaHCO3 и азотнокислого натрия NaNO3:
4NaHCO3+SiO2=Na4Si04+2H2O+4CO
Или
2NaNO3+SiO2=Na2O•SiO2+N2O5.
Однако следует иметь в виду, что во многих случаях сварки серого чугуна в состав флюса, помимо приведенных выше компонентов, вводимых в количестве 25-50%, входит также бура Na2B4O7, обладающая сильно выраженными кислыми свойствами. В некоторых же случаях флюс вообще представляет собой только буру, без каких-либо добавок. Объясняется это тем, что чугун, помимо высокого содержания в нем кремния, содержит также высокий процент углерода, требующего защиты сварочной ванны от кислорода воздуха. Бура же при расплавлении ее пламенем горелки хорошо растекается по поверхности металла, образует шлаковую пленку, достаточно надежно защищающую ванну от воздействия воздуха.
В то же время образующийся в результате разложения буры борный ангидрид связывает окислы железа и марганца в борнокислые соли
FeO+B2O3=FeO•B2O3;
МпО+В2О3=МпО•В2О3,
всплывающие в виде шлака на поверхность сварочной ванны.
При использовании газообразного флюса (азеотропной смеси метанола с метилборатом) на поверхности расплавленного металла образуется плотная, вязкая пленка боросиликатов, надежно защищающая сварочную ванну от попадания в нее газов из пламени и из воздуха.
Флюсы для сварки алюминия и его сплавов. В связи с тем, что тугоплавкая окись алюминия Аl2О3 (Тпл=2030°С) представляет собой чрезвычайно прочное химическое соединение, плохо поддающееся действию флюсующих веществ из-за своего химически нейтрального характера, флюсы для сварки алюминия должны обладать достаточно большой активностью. Наиболее сильно действующие растворители окиси алюминия - галоидные соединения щелочного металла лития. В связи с этим большинство флюсов для сварки алюминия содержит в своем составе хлористый или фтористый литий. Помимо соли лития, флюсы для сварки алюминия содержат также ряд других фтористых или хлористых солей калия, натрия и кальция. Наиболее активные компоненты флюса - соли лития и главным образом хлористый литий. Взаимодействие хлористого лития с окисью алюминия протекает по реакции
6LiCl+Аl2О3=2А1С13+3Li2O.
Образуемый в результате приведенной реакции хлористый алюминий улетучивается, так как его температура кипения всего 183°С, окисел же лития всплывает на поверхность ванны в виде шлака.
Флюсы для алюминия, содержащие хлористый литий, отличаются исключительно большой гигроскопичностью, в связи с чем хранить их следует в герметически закрываемых банках.
Флюсы, содержащие в своем составе хлористый литий, при наличии остатков флюса после окончания сварки на поверхности металла шва и околошовной зоны могут вызвать своеобразную коррозию металла, продолжая взаимодействовать с окисью алюминия, всегда присутствующей на поверхности металла. В связи с этим при использовании флюса с хлористым литием необходимо тщательно очистить поверхность сварного соединения от остатков флюса проволочной щеткой и промыть шов и околошовную зону 2%-ным раствором азотной кислоты (HNO3), а затем водой и просушить.
Помимо флюсов, содержащих химически активные элементы, при сварке алюминия находят также применение флюсы, сочетающие в известной мере физическое растворение окислов с химическим взаимодействием элементов. Процесс физического растворения имеет место тогда, когда в жидкой ванне, помимо основных и кислотных окислов, присутствуют некоторые соли, обладающие значительной способностью растворять окислы в расплавленном состоянии. Такой солью является, в частности, криолит AlF3•3NaF, растворяющий в расплавленном состоянии Аl2О3.



Уважаемый посетитель, Вы прочитали статью "2. Флюсы", которая опубликована в категории "Оборудование и технология". Если Вам понравилась или пригодилась эта статья, поделитесь ею, пожалуйста, со своими друзьями и знакомыми.
Наш сайт рекомендует:
2 мая 2016 | Просмотров: 6592 |